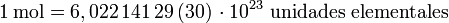1.-temperatura
2.-presión
3.-atmósfera
4.-volumen
5.-numero de moles (MOL)
fuentes:
- http://es.wikipedia.org/wiki/Temperatura
- http://es.wikipedia.org/wiki/Temperatura
- http://es.wikipedia.org/wiki/Atm%C3%B3sfera
- http://es.wikipedia.org/wiki/Volumen
- http://es.wikipedia.org/wiki/Mol
TEMPERATURA

PRESIÓN
La presión es una magnitud física que mide la proyección de la fuerza en dirección perpendicular por unidad de superficie, y sirve para caracterizar cómo se aplica una determinada fuerza resultante sobre una línea. En el Sistema Internacional de Unidades la presión se mide en una unidad derivada que se denomina pascal (Pa) que es equivalente a una fuerza total de un newton actuando uniformemente en un metro cuadrado. En el Sistema Inglés la presión se mide en libra por pulgada cuadrada (pound per square inch o psi) que es equivalente a una fuerza total de una libra actuando en una pulgada cuadrada.

ATMÓSFERA
La atmósfera es la capa de gas que rodea a un cuerpo celeste. Los gases son atraídos por la gravedad del cuerpo, y se mantienen en ella si la gravedad es suficiente y la temperatura de la atmósfera es baja. Algunos planetas están formados principalmente por gases, por lo que tienen atmósferas muy profundas.

VOLUMEN
El volumen es una magnitud escalar definida como la extensión en tres dimensiones de una región del espacio. Es una magnitud derivada de la longitud, ya que se halla multiplicando la longitud, el ancho y la altura. Desde un punto de vista físico, los cuerpos materiales ocupan un volumen por el hecho de ser extensos, fenómeno que se debe al principio de exclusión de Pauli.
La capacidad y el volumen son términos equivalentes, pero no iguales. Se define la capacidad de un recipiente como la "propiedad de una cosa de contener otras dentro de ciertos límites". La capacidad se refiere al volumen de espacio vacío de alguna cosa que es suficiente para contener a otra u otras cosas.
La unidad de medida de volumen en el Sistema Internacional de Unidades es el metro cúbico. Para medir la capacidad se utiliza el litro. Por razones históricas, existen unidades separadas para ambas, sin embargo están relacionadas por la equivalencia entre el litro y el decímetro cúbico:
- 1 dm3 = 1 litro = 0,001 m3 = 1000 cm3.
- NUMERO DE MOLES (MOL)
El mol (símbolo: mol) es la unidad con que se mide la cantidad de sustancia, una de las siete magnitudes físicas fundamentales del Sistema Internacional de Unidades.
Dada cualquier sustancia (elemento o compuesto químico) y considerando a la vez un cierto tipo de entidades elementales que la componen, se define como un mol a la cantidad de esa sustancia que contiene tantas entidades elementales del tipo considerado, como átomos hay en 12 gramos de carbono-12. Esta definición no aclara a qué se refiere cantidad de sustancia y su interpretación es motivo de debates, aunque normalmente se da por hecho que se refiere al número de entidades, como parece confirmar la propuesta de que a partir del 2011 la definición se base directamente en el número de Avogadro (de modo similar a como se define el metro a partir de la velocidad de la luz).
El número de unidades elementales –átomos, moléculas, iones, electrones, radicales u otras partículas o grupos específicos de éstas– existentes en un mol de sustancia es, por definición, una constante que no depende del material ni del tipo de partícula considerado. Esta cantidad es llamada número de Avogadro (NA) y equivale a:
| Estándar | Unidades básicas del Sistema Internacional |
| Magnitud | Cantidad de sustancia |
| Símbolo | mol |
| Equivalencias | 1 mol: |
| Cantidad: | 6,022 141 29 (30) × 102 |