





 en química y biología es la energía mínima que necesita un sistema antes de poder iniciar un determinado proceso. La energía de activación suele utilizarse para denominar la energía mínima necesaria para que se produzca una reacción química dada. Para que ocurra una reacción entre dos moléculas, éstas deben colisionar en la orientación correcta y poseer una cantidad de energía mínima. A medida que las moléculas se aproximan, sus nubes de electrones se repelen. Esto requiere energía (energía de activación) y proviene de la energía térmica del sistema, es decir la suma de la energía traslacional, vibracional, etcétera de cada molécula. Si la energía es suficiente, se vence la repulsión y las moléculas se aproximan lo suficiente para que se produzca una reordenación de los enlaces de las moléculas. La ecuación de Arrhenius proporciona la base cuantitativa de la relación entre la energía de activación y la velocidad a la que se produce la reacción. El estudio de las velocidades de reacción se denomina cinética química.
en química y biología es la energía mínima que necesita un sistema antes de poder iniciar un determinado proceso. La energía de activación suele utilizarse para denominar la energía mínima necesaria para que se produzca una reacción química dada. Para que ocurra una reacción entre dos moléculas, éstas deben colisionar en la orientación correcta y poseer una cantidad de energía mínima. A medida que las moléculas se aproximan, sus nubes de electrones se repelen. Esto requiere energía (energía de activación) y proviene de la energía térmica del sistema, es decir la suma de la energía traslacional, vibracional, etcétera de cada molécula. Si la energía es suficiente, se vence la repulsión y las moléculas se aproximan lo suficiente para que se produzca una reordenación de los enlaces de las moléculas. La ecuación de Arrhenius proporciona la base cuantitativa de la relación entre la energía de activación y la velocidad a la que se produce la reacción. El estudio de las velocidades de reacción se denomina cinética química.

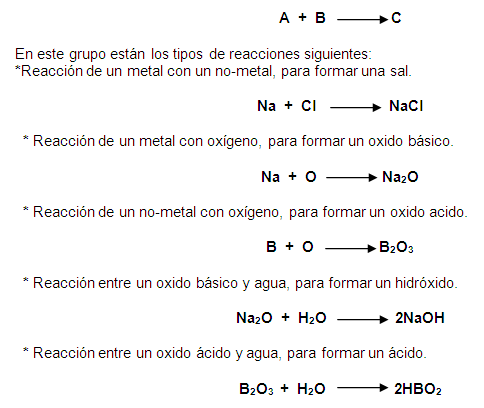

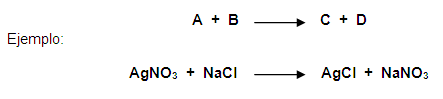
Nombre
|
Descripción
|
Representación
| ||
Reacción de síntesis
|
Elementos o compuestos sencillos se unen para formar un compuesto más complejo.
|
A+B ? AB
| ||
Reacción de descomposición
|
Un compuesto se fragmenta en elementos o compuestos más sencillos.
|
AB ? A+B
| ||
Reacción de desplazamiento simple
|
Un elemento reemplaza a otro en un compuesto.
|
A + BC ? AB + C
| ||
Reacción de doble desplazamiento
|
Los iones en un compuesto cambian lugares con los iones de otro compuesto para formar dos sustancias diferentes.
|
AB + CD ? BC + AD
| ||



 .
.
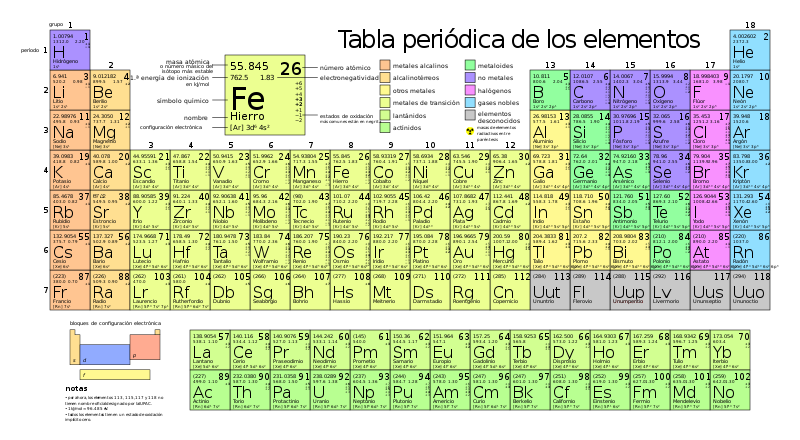
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A | |
| Periodo | ||||||||||||||||||
| 1 | 1 H | 2 He | ||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr |
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe |
| 6 | 55 Cs | 56 Ba | ✶ | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn |
| 7 | 87 Fr | 88 Ra | ◘ | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Fl | 115 Uup | 116 Lv | 117 Uus | 118 Uuo |
| ✶ | Lantánidos | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |
| ◘ | Actínidos | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr |
| Alcalinos | Alcalinotérreos | Lantánidos | Actínidos | Metales de transición |
| Metales del bloque p | Metaloides | No metales | Halógenos | Gases nobles y Transactínidos |